Dystrophe Epidermolysis bullosa: Die Gentherapie ist da
Bislang gibt es keine zugelassene kausale Behandlung für die dystrophe Epidermolysis bullosa. Das könnte sich bald ändern: In einer Phase-III-Studie verbesserte die topische Gentherapie Beremagene Geperpavec (B-VEC) die Wundheilung und linderte die Schmerzen.
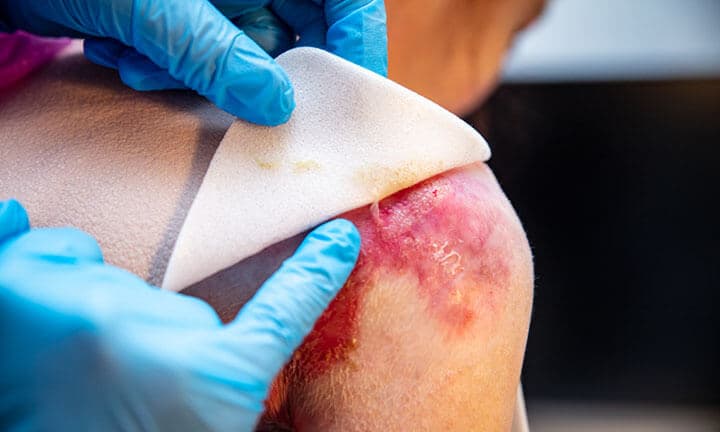
Die Gentherapie mit Beremagene Geperpavec verbesserte nicht nur die Wundheilung, sondern verringerte auch die Schmerzen der Patienten beim Verbandswechsel.
Die dystrophen Epidermolysis bullosa (DEB) bezeichnet alle Formen der Epidermolysis bullosa, bei denen die strukturelle Integrität in den oberflächlichen Schichten der Dermis fehlen. Dadurch entwickeln sich in dieser Hautschicht schmerzhafte Hautblasen. Namensgebend für die "dystrophe" Form der Erkrankung sind eine Reihe an Ernährungsproblemen, die ebenfalls mit der genetisch bedingten Störung einher gehen.
Fehler im COL7A1-Gen sind für die dystrophe Epidermolysis bullosa verantwortlich
Verantwortlich für die DEB ist eine dominant oder rezessiv vererbte Mutation im Kollagen-Typ-VII-Gen (COL7A1) und der damit verbundene Verlust von Ankerfibrillen, die Dermis und Epidermis miteinander verbinden. Die DEB kann eine Reihe von Folgeerkrankungen wie lebensbedrohliche Infektionen, Plattenepithelkarzinome und Deformierungen der Gliedmassen nach sich ziehen.
Schon seit Längerem gibt es Bemühungen, Kollagen-VII bei DEB-Patienten über eine Gentherapie zu ersetzen und ihnen damit die Chance auf Heilung zu ermöglichen. Nun scheint ein wichtiger Meilenstein am Weg dorthin gelungen zu sein, wie die Ergebnisse einer Phase-3-Studie (1) nahelegen. Gegenstand der Studie ist eine direkt auf die Wunden aufgetragene Gentherapie bestehend aus dem rekombinanten Molekül Beremagene Geperpavec (B-VEC). B-VEC besteht aus zwei funktionellen Kopien des mit 9 kbp relativ grossen ColV7A1-Gen. Als Transportvektor dient ein nicht replikationsfähiger Herpes-Simplex-Virus-Typ-1.
In der Europäischen Union zumindest ist die Zulassung B-VEC dank eines positiven Votums des Ausschusses für Pädiatrie letzten September mittlerweile greifbar.
Wundverschluss hält über mindestens sechs Monate an
In der vorliegenden Studie wählten die Forscher bei jedem der 31 Teilnehmenden (6 Monate oder älter, Durchschnittsalter 16 Jahre) zwei Wunden ähnlicher Fläche (ca. 10 cm²) und Lage aus. Bei jedem der Patienten wurde sodann 26 Wochen lang eine Wunde einmal wöchentlich mit B-VEC, und eine mit Placebo behandelt.
Nach sechs Monaten hatten sich 67 Prozent der mit B-VEC behandelten und 22 Prozent der mit Placebo behandelten Wunden vollständig geschlossen (primärer Endpunkt). Eine vollständige Wundheilung nach drei Monaten trat bei 71 Prozent der mit der Gentherapie behandelten Wunden ein, verglichen mit 20 Prozent bei mit Placebo behandelten. Dabei scheint die Wirksamkeit der Gentherapie von Dauer zu sein. So waren 50 Prozent der behandelten Wunden auch noch nach sechs Monaten vollständig verschlossen, in der Placebogruppe waren es nur 7 Prozent.
Darüber hinaus verringerte der Wirkstoff die Schmerzintensität beim Wundverbandwechsel etwas mehr als unter Placebo.
Die Behandlung wurde von den Patienten gut vertragen. Rund 58 Prozent der Patienten hatten milde oder mittelschwere Nebenwirkungen wie Pruritus und Schüttelfrost. Bei drei Patienten traten Plattenepithelkarzinome auf. Diese befanden sich jedoch in allen Fällen an den mit Placebo behandelten Hautstellen.
Obwohl die meisten Patienten, die anfänglich keine Antikörper gegen HSV oder Kollagen Typ VII hatten, während der Studie eine Serokonversion aufwiesen, wurden keine klinisch bedeutsamen immunologischen Reaktionen beobachtet.
Aktuell werden weitere neue Ansätze gegen die dystrophe Epidermolysis bullosa entwickelt
Neben der Gentherapie mit B-VEC befinden sich mehrere Ansätze zur Wiederherstellung der Kollagen-Funktion bei DEB in der klinischen Entwicklung. Dazu gehören etwa autologe COL7A1 produzierende Keratinozyten bzw. Fibroblasten, sowie eine intravenöse Kollagen-Typ-7-Protein-Ersatztherapie. Nachteil von Ersteren ist, dass dazu Patientenzellen erst modifiziert und wieder retransplantiert werden müssen.
Auch der Einsatz von Birkenterpenen kann den Wundverschluss beschleunigen (siehe Kasten). Die langfristige Wirksamkeit und Sicherheit all dieser Therapien müssen in grösseren Patientenkohorten weiter untersucht werden.
Birkenterpene auf dem Prüfstand
Die EASE-Studie widmete sich der Wirksamkeit und Sicherheit von Oleogel-S10 bei 223 Patienten mit einer Epidermolysis bullosa. Das Gel bestand aus 10% Birkenterpenen und 90% Sonnenblumenöl, das Kontrollgel enthielt keine Terpene. Während der Doppelblindphase erreichte ein höherer Prozentsatz der Teilnehmer mit dem Verum den primären Studienendpunkt, nämlich einen Verschluss der Zielwunde innerhalb von 45 Tagen (41,3 vs. 28,9%).
Damit lag die Wahrscheinlichkeit für den Wundschluss mit Oleogel-S10 um 44% höher, berichtet Prof. Dr. Dimitra Kiritsi von der Klinik für Dermatologie und Venerologie am Universitätsklinikum Freiburg auf dem 05. Wundkongress. Die Studie war Grundlage für die Zulassung des Gels.
An den 90 Tage langen, verblindeten Studienabschnitt schloss sich eine offene Phase über zwei Jahre an. In dieser wurden die prozentuale Gesamtkörperwundlast (Body Surface Area percentage, BSAP) und die Sicherheit bei 205 der mit den Triterpenen behandelten Patienten untersucht. Der BSAP sank in dieser Zeit unter dem Verum kontinuierlich weiter, nach 15 Monaten fand man eine Reduktion um 55%, die vorher erzielte Reduktion der Krankheitsaktivität blieb erhalten. Neue Sicherheitssignale liessen sich unter der längeren Anwendung nicht verzeichnen.
Referenzen
- Guide SV et al. Trial of Beremagene Geperpavec (B-VEC) for Dystrophic Epidermolysis Bullosa. N Engl J Med. 2022 Dec 15;387(24):2211-2219. doi: 10.1056/NEJMoa2206663
- Payne AS. Topical Gene Therapy for Epidermolysis Bullosa. N Engl J Med. 2022 Dec 15;387(24):2281-2284. doi: 10.1056/NEJMe2213203