Morbus Wilson und Hämochromatose erkennen
Um Folgeschäden der Leberstoffwechselerkrankungen Morbus Wilson und Hämochromatose zu verhindern, ist es wichtig, die Krankheiten früh zu diagnostizieren und gezielt zu behandeln. Besonders der Morbus Wilson kann sich auf unterschiedliche Weise äussern und wird daher oft erst spät entdeckt.
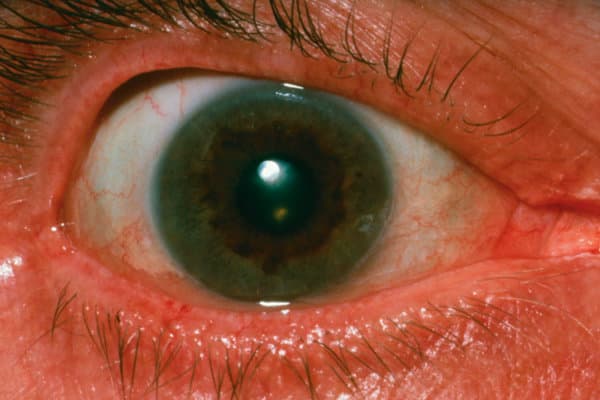
Hinter dem Morbus Wilson steckt eine Kupferspeicher-Erkrankung, die hepatische und/oder neuropsychiatrische Symptome verursacht.
Ein Kayser-Fleischer-Kornealring kann dabei ebenfalls auftreten.
Morbus Wilson: Gestörter Kupfertransport
Ein Morbus Wilson hat somit viele Gesichter, schreiben Professor Dr. Uta Merle und Dr. Isabelle Mohr von der Universität Heidelberg in einer Übersichtsarbeit (1).
Die Erkrankung ist dabei auf eine Mutation im ATP7B-Gen zurückzuführen, die das Morbus-Wilson-Protein beeinträchtigt. Dieses Protein ist normalerweise für den Transport von Kupfer zur Ausscheidung in die Gallenflüssigkeit zuständig. Wenn dieser Transport gestört ist, kommt es zu einer Kupferüberladung, hauptsächlich in der Leber, aber auch im Gehirn und in der Kornea.
Die meisten Patienten entwickeln zwischen dem fünften und 35. Lebensjahr erstmals Symptome. In etwa fünf Prozent der Fälle manifestiert sich Morbus Wilson mit akutem Leberversagen, das mit einer Coombs-negativen hämolytischen Anämie einhergehen kann, schreiben die Autorinnen. Die Leber kann auf verschiedene Weise auffällig werden, wie z.B. durch eine asymptomatische Hepatomegalie und/oder Splenomegalie, Steatosis hepatis, akute oder chronische Transaminasen-Erhöhung, kompensierte oder dekompensierte Leberzirrhose.
Das neurologische Symptomspektrum umfasst Tremor, Ataxie, Hypersalivation, Dysarthrie oder Dysgrafie sowie psychiatrische Auffälligkeiten. Etwa 50 Prozent der Patienten mit hauptsächlich hepatischer Symptomatik weisen einen typischen Kayser-Fleischer-Kornealring auf.
Ziel beim Morbus Wilson: eine negative Kupferbilanz
Für die Diagnose sind die Parameter des Kupferstoffwechsels wegweisend: ein niedriger Coeruloplasmin-Spiegel, eine erniedrigte Kupferkonzentration im Serum und eine erhöhte Kupferausscheidung von mehr als 1,6 mol / 24 h bzw. 100 g / 24 h im 24-Stunden-Sammelurin. Die Leberbiopsie ist der diagnostische Goldstandard. Dabei bestimmt man den Kupfergehalt im Trockengewicht des Leberpräparats. Verdacht auf einen Morbus Wilson erregen Werte über 250 Mikrogramm pro Gram.
Zusätzlich kann der sogenannte Leipzig-Score für die Diagnosestellung verwendet werden. Dieser umfasst alle relevanten diagnostischen Tests. Die Autorinnen empfehlen ein Familienscreening bei allen Verwandten ersten Grades eines Morbus-Wilson-Patienten.
Die Patienten erhalten eine lebenslange Therapie mit Kupferchelatoren wie D-Penicillamin und Triethylentetramin/Trientin sowie Zinksalzen. Das therapeutische Ziel ist es, eine negative Kupferbilanz zu erreichen und aufrechtzuerhalten. Verlaufskontrollen werden alle sechs Monate empfohlen, hierfür bieten sich neben den Leberwerten die Kupferausscheidung im 24-Stunden-Sammelurin und das nicht an Coeruloplasmin gebundene Kupfer an.
Hämochromatose: Gestörte Eisenresorption

Bei der Hämochromatose kommt es zu einer Eisenüberladung. Die Eisendepots (braun) finden sich z.B. in den Hepatozyten.
Bei der Hämochromatose führt eine erhöhte intestinale Eisenresorption zu einer Eisenüberladung, die Leber, Pankreas-B-Zellen, Herz, endokrine Organe und Gelenke schädigt. Es gibt die HFE(High Fe)-assoziierte Hämochromatose und seltener Non-HFE-Hämochromatosen. Die häufigste Form der Hämochromatose in westlichen Ländern ist die autosomal-rezessiv vererbte HFE-assoziierte Hämochromatose mit homozygoter C282Y-Mutation des HFE-Gens.
Die erhöhte Eisenresorption bei der HFE-assoziierten Hämochromatose wird durch eine Verminderung von Hepcidin verursacht, das normalerweise die Eisenaufnahme reduziert. Das überschüssige Eisen (ca. 2 bis 3 mg pro Tag) führt zur Eisenüberladung.
Die erhöhte Eisenresorption wird bei der HFE-assoziierten Hämochromatose durch eine Verminderung des Hepcidins verursacht. Hepcidin sorgt normalerweise für eine Reduktion der Eisenaufnahme. Das überschüssige Eisen (ca. 2–3 mg pro Tag) führt zur Eisenüberladung.
Je nach Stadium kann sich die Eisenüberladung zunächst mit unspezifischen Symptomen bemerkbar machen. Im Verlauf führt die Lebererkrankung zu Fibrose und Zirrhose. Es können auch Folgeschäden an Pankreas (Diabetes mellitus), Herz (Kardiomyopathie), Hypophyse und Gonaden (Unterfunktion), Haut (Pigmentierung) und Gelenken (Arthropathie) entstehen.
Betroffene Frauen entwickeln meist erst in der Postmenopause Beschwerden. Bei Männern zeigen sich Symptome häufig bereits früher, um das 45. Lebensjahr, schreiben die Autorinnen.
Aderlasstherapie ist die effektivste Methode
Eine deutliche Erhöhung der Transferrinsättigung (> 90 %) in Kombination mit einem erhöhten Serum-Ferritin weist auf eine klassische Hämochromatose hin. Bei Nachweis einer HFE-C282Y-Mutation in Kombination mit erhöhten Eisenstoffwechselparametern kann die Diagnose gestellt werden. Eine Leberbiopsie ist in dieser Konstellation nicht erforderlich.
Die Aderlasstherapie ist die effektivste Methode, um das überschüssige Eisen aus dem Körper zu entfernen. Sie ist ein Leben lang indiziert. Der Therapieerfolg sollte anhand der Bestimmung der Serum-Ferritin-Werte alle zwei bis drei Monate kontrolliert werden, so die Autorinnen.
- Merle U, Mohr I. Hereditäre Lebererkrankungen: Morbus Wilson und Hämochromatose [Hereditary Liver Diseases: Wilson's Disease and Hemochromatosis]. Dtsch Med Wochenschr. 2023 Jul;148(13):836-843. German. doi: 10.1055/a-1871-6393